氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①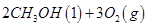 =
= mol
mol
② =
= mol
mol
③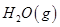 =
=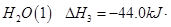 mol
mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式 。
(2)生产甲醇的原料CO和H2来源于下列反应: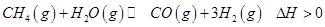
①一定条件下 的平衡转化率与温度、压强的关系如图a。则
的平衡转化率与温度、压强的关系如图a。则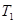
 (填“<”、“>”或“=",下同);A、B、C三点处对应平衡常数(
(填“<”、“>”或“=",下同);A、B、C三点处对应平衡常数(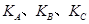 )的大小关系为 ;
)的大小关系为 ;
②100℃时,将1 mol  和2 mol
和2 mol 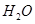 通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 (填序号)。
通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 (填序号)。
a.容器的压强恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 molH2
c.容器内气体密度恒定
d.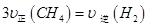
如果达到平衡时 的转化率为0.5,则100℃时该反应的平衡常数K= 。
的转化率为0.5,则100℃时该反应的平衡常数K= 。
(3)某实验小组利用CO(g)、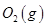 、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为 。
、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为 。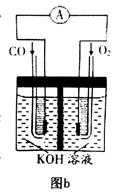
相关知识点
推荐试卷
 粤公网安备 44130202000953号
粤公网安备 44130202000953号