尿素(H2NCONH2)是有机态氮肥,在农业生产中有着非常重要的作用。
(1)工业上合成尿素的反应分两步进行:
第一步:2NH3(l)+CO2 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1
第二步:H2NCOONH4 (l)  H2O+ H2NCONH2(l)△H2
H2O+ H2NCONH2(l)△H2
某化学学习小组模拟工业上合成尿素的条件,在体积为1 L的密闭容器中投入4 mol NH3和1 mol CO2,实验测得反应中各组分的物质的量随时间的变化如下图I所示。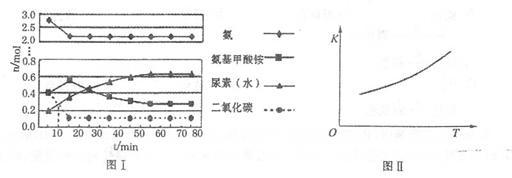
①已知总反应的快慢是由较慢的一步反应决定的。则合成尿素总反应的快慢由第______步反应决定,总反应进行到______min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上右图II所示,则ΔH2______0(填“>”、“<”或“=”。)
(2)该小组将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡: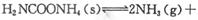
 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
| 温度/℃ |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强/Kpa |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度/10-3mol/L |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡状态的标志是____________。
A.2V(NH3)=V(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0°C时该分解反应的平衡常数为______(保留小数点后一位)。
(3)已知:
N2(g)+O2(g)=2NO(g) △H1=+180.6KJ/mol
N2(g)+3H2(g)=2NH3(g) △H2=-92.4KJ/mol
2H2(g)+O2(g)=2H2O(g) △H3=-483.6KJ/mol
则4NO(g)+4NH3(g) +O2(g)= 4N2(g)+6 H2O(g)的△H=___kJ • mol-1。
(4)尿素燃料电池的结构如图所示。其工作时负极电极反应式可表示为______。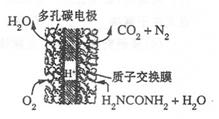
 粤公网安备 44130202000953号
粤公网安备 44130202000953号