甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
⑴工业生产甲醇的常用方法是:CO(g)+2H2(g) CH3OH(g) △H=-90.8 kJ/mol。
CH3OH(g) △H=-90.8 kJ/mol。
已知:2H2(g)+ O2(g)= 2H2O (l) △H=-571.6 kJ/mol
H2(g) +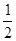 O2(g) = H2O(g) △H=-241.8 kJ/mol
O2(g) = H2O(g) △H=-241.8 kJ/mol
①H2的燃烧热为 ▲ kJ/mol。
②CH3OH(g)+O2(g) CO(g)+2H2O(g)的反应热△H= ▲ 。
CO(g)+2H2O(g)的反应热△H= ▲ 。
③若在恒温恒容的容器内进行反应CO(g)+2H2(g) CH3OH(g),则可用来判断该反应达到平衡状态的标志有 ▲ 。(填字母)
CH3OH(g),则可用来判断该反应达到平衡状态的标志有 ▲ 。(填字母)
| A.CO百分含量保持不变 |
| B.容器中H2浓度与CO浓度相等 |
| C.容器中混合气体的密度保持不变 |
| D.CO的生成速率与CH3OH的生成速率相等 |
⑵工业上利用甲醇制备氢气的常用方法有两种:
①甲醇蒸汽重整法。该法中的一个主要反应为CH3OH(g) CO(g)+2H2(g),此反应能自发进行的原因是 ▲ 。
CO(g)+2H2(g),此反应能自发进行的原因是 ▲ 。
②甲醇部分氧化法。在一定温度下以Ag/CeO2—ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应方程式为 ▲ ;在制备H2时最好控制n(O2)/n(CH3OH)= ▲ 。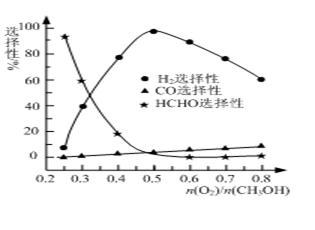
⑶在稀硫酸介质中,甲醇燃料电池负极发生的电极反应式为 ▲ 。
相关知识点
推荐试卷
 粤公网安备 44130202000953号
粤公网安备 44130202000953号