BaS是一种白色晶体,微溶于水,可用于制备立德粉、Na2S等。工业上可用H2与重晶石(BaSO4)在高温下反应制备BaS,热化学方程式为BaSO4(s)+4H2(g) BaS(s)+4H2O(g)
BaS(s)+4H2O(g)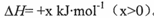 。回答下列问题:
。回答下列问题:
(1)在温度和容积不变的条件下,能说明该反应己达到平衡状态的是 (填字母序号)。
a.n(H2)=n(H2O)
b.容器内压强保持不变
c.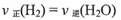
d.水蒸气的浓度保持不变
(2)平衡后下列措施既可提高反应速率,又可提高H2的转化率的是 (填字母序号)。
a.使用催化剂
b.升高反应体系的温度
c.增大反应容器的体积
d.及时从反应体系中分离出水蒸气
(3)将温度恒定为T℃,向体积为2L的密闭容器中加入一定量的重晶石和H2。在不同时间测得H2的物质的量如下表:
①2t时,n 1.20(填“>”、“<”或“=”)
②若氢气的平衡转化率为a,则该温度下反应的化学平衡常数K= (用含a的
代数式表示);若测得该反应达到平衡时吸热Q kJ ,则x= (用含a、Q的代数式表示)。
(4)为了探究温度、固体反应物的表面积对化学反应速率的影响,某同学在一固定容积的密闭容器中加入一定量的重晶石和H2,设计了下表中的三组实验: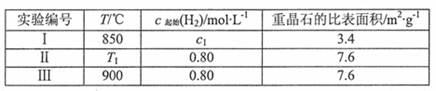
①填写上表中的实验条件: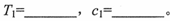
②在直角坐标系中画出I, II两组实验氢气的浓度随时间变化趋势图,并在每条曲线上标明对应的实验编号。
相关知识点
推荐试卷
 粤公网安备 44130202000953号
粤公网安备 44130202000953号