甲醇来源丰富,价格低廉,是一种重要的化工原料,有着非常重要、广泛的用途。工业上通常用水煤气在恒容、催化剂和加热的条件下生产甲醇,其热化学方程式为:
2H2(g)+CO(g) CH3OH(g) ΔH=-90.8kJ/mol。
CH3OH(g) ΔH=-90.8kJ/mol。
(1)该反应的平衡常数表达式为:K= ,如升高温度,K值将 (填:增大、减小或不变)。
(2)以下各项不能说明该反应达到平衡状态的是 .
A、混合气体的密度保持不变 B、甲醇的质量分数保持不变
C、CO的浓度保持不变 D、2v逆(H2)=v正(CH3OH)
(3)在2100C、2400C和2700C三种不同温度、2L恒容密闭容器中研究合成甲醇的规律。
上图是上述三种温度下不同的H2和C0的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系,则曲线Z对应的温度是 。由起始达到a点所需时间为5min,则H2的反应速率 mol/(L·min)。
(4)某兴趣小组设计了如图所示的甲醇燃料电池装置。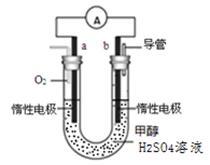
①该电池工作时,正极是 极(填“a”或 “b”);
②该电池负极反应的离子方程式为 。
相关知识点
推荐试卷
 粤公网安备 44130202000953号
粤公网安备 44130202000953号