【化学—选修2化学与技术】(15分)
氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下: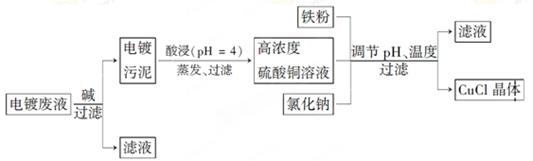
金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图。
【已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】
请回答下列问题:
(1)酸浸时发生反应的离子方程式是________;析出CuCl晶体时的最佳pH在_______左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2 h、冷却密封包装。70℃真空干燥、密封包装的目的是_____________________________________。
(4)产品滤出时所得滤液的主要分成是________,若想从滤液中获取FeSO4·7H2O晶体,还需要知道的是__________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:____________________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是_____________。
相关知识点
推荐试卷
 粤公网安备 44130202000953号
粤公网安备 44130202000953号