A.原子序数小于36的、、、四种元素,其中是形成化合物种最多的元素,原子基态时最外层电子数是其内层电子数的2倍,原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。
回答下列问题:
(1)分子中原子轨道的杂化类型为,1含有键的数目为。
(2)化合物的沸点比化合物的高,其主要原因是。
(3)元素的一种氧化物与元素的一种氧化物互为等电子体,元素的这种氧化物的分子式是。
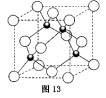
(4)元素的一种氯化物晶体的晶胞结构如图13所示,该氯化物的化学式是,它可与浓盐酸发生非氧化还原反应,生成配合物,反应的化学方程式为。
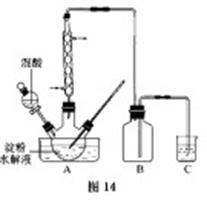
B.草酸是一种重要的化工产品。实验室用硝酸氧化淀粉水解液制备草酸的装置如图14所示(加热、搅拌和仪器固定装置均已略去)
实验过程如下:
①将一定量的淀粉水解液加入三颈瓶中
②控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65与98%的质量比为2:1.5)溶液
③反应3左右,冷却,抽滤后再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
↑↑
↑
↑
(1)检验淀粉是否水解完全所需用的试剂为
(2)实验中若混酸滴加过快,将导致草酸产率下降,其原因是
(3)装置用于尾气吸收,当尾气中=1:1时,过量的溶液能将,全部吸收,原因是用化学方程式表示)
(4)与用溶液吸收尾气相比较,若用淀粉水解液吸收尾气,其优、缺点是。
(5)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有 。
相关知识点
推荐试卷
 粤公网安备 44130202000953号
粤公网安备 44130202000953号