硫酸工业在国民经济中占有重要地位。
(1)我国古籍记载了硫酸的制备方法——“炼石胆( )取精华法”。借助现代仪器分析,该制备过程中 分解的TG曲线(热重)及 曲线(反映体系热量变化情况,数值已省略)如图所示。 左右有两个吸热峰,则此时分解生成的氧化物有 、_____和_____(填化学式)。
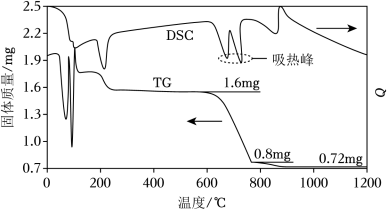
(2)铅室法使用了大容积铅室制备硫酸( 以下),副产物为亚硝基硫酸,主要反应如下:
ㅤ
(i)上述过程中 的作用为_____。
(ii)为了适应化工生产的需求,铅室法最终被接触法所代替,其主要原因是__________(答出两点即可)。
(3)接触法制硫酸的关键反应为 的催化氧化:
(i)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率( )下反应速率(数值已略去)与温度的关系如图所示,下列说法正确的是_____。
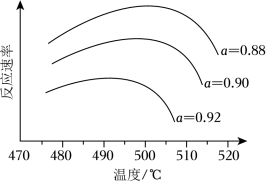
| A. |
温度越高,反应速率越大 |
| B. |
的曲线代表平衡转化率 |
| C. |
越大,反应速率最大值对应温度越低 |
| D. |
可根据不同 下的最大速率,选择最佳生产温度 |
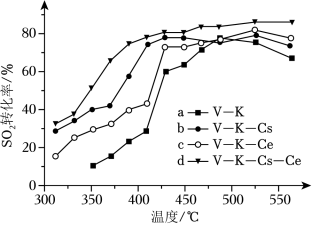
(ii)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如图所示,催化性能最佳的是_____(填标号)。
(iii)设 的平衡分压为 , 的平衡转化率为 ,用含 和 的代数式表示上述催化氧化反应的 _____(用平衡分压代替平衡浓度计算)。
推荐试卷
 粤公网安备 44130202000953号
粤公网安备 44130202000953号