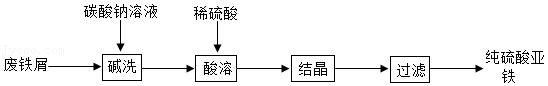
硫酸亚铁是一种重要的补铁剂。实验室以废铁屑(含少量Fe2O3)为原料制备硫酸亚铁晶体的流程如图所示:
已知:铁与硫酸铁反应的化学方程式为Fe+Fe2(SO4)3═3FeSO4。
(1)“碱洗”是为了洗去铁屑表面的油污。用热的碳酸钠溶液浸泡,过滤,再用蒸馏水洗涤2~3次。取最后一次洗涤液,测其pH,若pH= ,说明洗涤液中无碳酸钠。
(2)“酸溶”是向“碱洗”过的铁屑中加入过量稀硫酸。
①写出铁与稀硫酸反应的化学方程式: 。
②所用硫酸溶液浓度不能太稀,原因是 。
③废铁屑中的少量Fe2O3不需要进行除杂处理,原因是 。
(3)“结晶”的相关操作依次为:蒸发浓缩、降温结晶。蒸发浓缩的目的是 ,便于结晶。
(4)含量测定:准确称取制得的硫酸亚铁样品2.82g于锥形瓶中,加蒸馏水完全溶解,加入稀硫酸,滴加溶质质量分数为1.58%的高锰酸钾溶液,当恰好完全反应时,消耗高锰酸钾溶液的体积为20.00mL(该高锰酸钾溶液密度近似为1g•mL﹣1)。列式计算该样品中硫酸亚铁的含量(结果用百分数表示,保留一位小数)。
已知:高锰酸钾与硫酸亚铁反应的化学方程式为10FeSO4+2KMnO4+8H2SO4═5Fe2(SO4)3+2MnSO4+K2SO4+8H2O(相对分子质量:FeSO4=152,KMnO4=158)
相关知识点
推荐试卷
 粤公网安备 44130202000953号
粤公网安备 44130202000953号