某学习小组将足量Zn条插入一定量的浓H2SO4中,发现Zn表面有大量气泡产生。(注:随着反应进行,硫酸浓度逐渐变小)
【提出问题】气体的成分是什么?
【猜想假设】猜想一:只有SO2
猜想二:只有H2
猜想三:
【查阅资料】(Ⅰ)SO2可以使品红溶液褪色
(Ⅱ)SO2可以和碱性溶液反应
(Ⅲ)H2+CuO Cu+H2O
【实验探究】用如图装置验证猜想(部分夹持仪器省略)
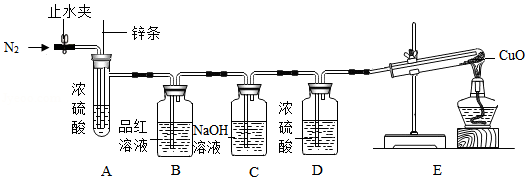
【方案设计】
主要实验步骤 |
主要现象 |
解释或结论 |
①打开止水夹,先通入一段时间N2 |
/ |
/ |
②关闭止水夹,将足量Zn条下放,浸入浓硫酸中,点燃E装置处酒精灯 |
B装置处品红溶液褪色 E装置处 |
猜想三成立 |
③结束实验 |
/ |
/ |
【表达交流】
(1)在步骤①中,通入N2的目的是: 。
(2)请你设计一个实验,用化学方法证明E装置中CuO未完全反应。
实验步骤 |
实验现象 |
结论 |
|
|
CuO未完全反应 |
【反思拓展】
(1)请你根据上述实验探究,补充Zn与浓硫酸反应的化学方程式
Zn+2H2SO4═ZnSO4+SO2↑+ 。
(2)已知Al与H2一样,在加热条件下能与CuO发生化学反应,请写出该反应的化学方程式 。
相关知识点
推荐试卷
 粤公网安备 44130202000953号
粤公网安备 44130202000953号