工业铁红主要成分是Fe 2O 3,还含有少量的FeO、Fe 3O 4。
【查阅资料】1.草酸晶体(H 2C 2O 4•3H 2O)在浓硫酸作用下受热分解,化学方程式为:H 2C 2O 4•3H 2O 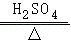 CO 2↑+CO↑+4H 2O。
CO 2↑+CO↑+4H 2O。
2.碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。
3.铁的常见氧化物中铁的质量分数:
铁的氧化物 |
FeO |
Fe 2O 3 |
Fe 3O 4 |
铁的质量分数 |
77.8% |
70.0% |
72.4% |
【问题讨论】为了测定铁红中铁的质量分数,小组同学进行如下实验。(装置气密性良好)
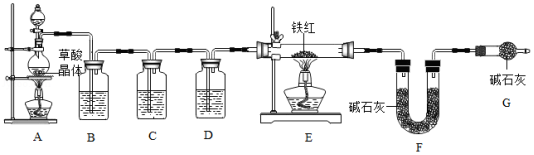
(1)该实验为了保证进入E中的气体是纯净、干燥的CO,则B、C、D中的试剂依次是 。(填字母序号)
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(2)C装置的作用是 。
(3)写出E装置中所发生反应的一个化学方程式: 。
(4)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数。
①若E中充分反应后得到铁粉的质量为mg,则 <m< 。
②若实验前后称得F装置增重7.7g,则此铁红中铁的质量分数是 。
【实验反思】
(1)如果缺少装置G(不考虑其他因素),则测得样品中铁的质量分数会 (选填"偏小""不变"或"偏大")。
(2)该实验装置的一个明显缺陷是 。
相关知识点
推荐试卷
 粤公网安备 44130202000953号
粤公网安备 44130202000953号