工业合成氨是人工固氮方法之一。
I.已知下列物质的键能:

则N2(g)+3H2(g)=2NH3(g) △H=_____________。
Ⅱ.恒温下,将一定量N2、H2置于10L的容器中发生反应,反应过程中各物质浓度随时间变化如下图。
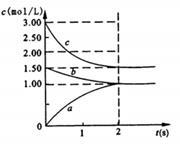
(1)图中0~2s内的反应速率v(H2)= ;该温度下平衡常数的计算表达式为__________。
(2)该反应达到平衡的标志为 (填序号)。
| A.混合气体的平均相对分子质量不变 |
| B.物质的量浓度比等于系数比 |
| C.容器内温度不变 |
| D.断裂1moIH-H键同时断裂2molN-H键 |
(3)若其它条件不变,将恒容条件变为恒压,则平衡时c(N2) (填“增大”、“减小”、“不变’’或“不能确定”)。
(4)哈伯研究所因证实N2、H2在固体催化剂(Fe)表面吸附和解吸以合成氨的过程而获诺贝尔奖。若用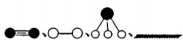 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:

①吸附后,能量状态最低的是 (填字母序号)。
②由上述原理,在铁表面进行NH3的分解实验,发现分解速率与浓度关系如图。从吸附和解吸过程分析,c0前速率增加的原因可能是 ;c0后速率降低的原因可能是 。

相关知识点
推荐试卷
 粤公网安备 44130202000953号
粤公网安备 44130202000953号