某研究小组以粗盐和碳酸氢铵(NH4HCO3)为原料,采用以下流程制备纯碱和氯化铵。
已知盐的热分解温度: NH4HCO3 36℃; NaHCO3 270℃; NH4Cl 340℃; Na2CO3 >850℃
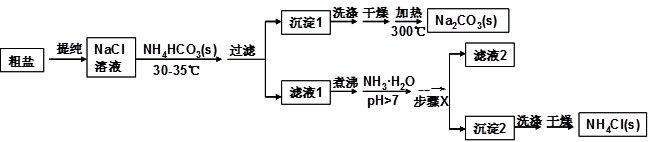
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有:①NaOH ②BaCl2 ③HCl ④Na2CO3,其加入的顺序合理的是
| A.①③④② | B.①②④③ | C.③②④① | D.①②③④ |
过滤中用到玻璃棒的作用是 ;
(2)如何判断粗盐中SO42-是否已除尽? ;
(3)从NaCl溶液到沉淀1的过程中,需蒸发浓缩。在加入固体NH4HCO3之前进行蒸发浓缩优于在加入NH4HCO3之后,原因是 ;
(4)写出沉淀1受热分解的化学方程式 ;
(5)为提高NH4Cl产品的产率和纯度,需在滤液中加入氨水,理由是 ;
步骤X包括的操作有 ;
(6)采用“甲醛法”测定工业产品中氯化铵的纯度(假定杂质不与甲醛反应),反应原理为:4NH4Cl+6HCHO→(CH2)6N4+4HCl+6H2O 某技术人员称取1.5g该样品溶于水,加入足量的甲醛并加水配成100mL溶液。从中取出10mL,滴入酚酞再用0.1mol/L的NaOH溶液滴定,到滴定终点时消耗NaOH溶液25.00mL。则该样品中氯化铵的质量分数为 。
相关知识点
推荐试卷
 粤公网安备 44130202000953号
粤公网安备 44130202000953号