目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2+3H2 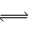 CH3OH+H2O,该反应的能量变化如图所示:
CH3OH+H2O,该反应的能量变化如图所示:
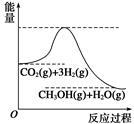
(1)甲同学认为该反应为放热反应,他的理由为: 。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5min末,用CO2浓度变化表示的平均反应速率v(CO2)= ;反应达到平衡状态,此时H2的转化率为 。
| t/min |
0 |
2 |
5 |
10 |
15 |
| n(CO2)/mol |
1 |
0.75 |
0.5 |
0.25 |
0.25 |
(3)在相同温度、容积不变的条件下,能说明该反应已达平衡状态的是 (填序号)。
a.v生成(CH3OH)=v消耗(CO2)
b.CO2、H2、CH3OH、H2O的浓度均不再变化
c.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶1∶1∶1
d.H2的消耗速率与CH3OH的消耗速率之比为3∶1
相关知识点
推荐试卷
 粤公网安备 44130202000953号
粤公网安备 44130202000953号