硫酰氯(SO2Cl2)是重要的化学试剂,可由如下反应制取:SO2(g)+Cl2(g)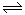 SO2Cl2(g)△H
SO2Cl2(g)△H
针对该反应回答下列问题:
(1)已知:①SO2(g)+Cl2(g)+SCl2(g)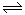 2SOCl2(g)△H1=-akJ/mol
2SOCl2(g)△H1=-akJ/mol
②SO2Cl2(g)+SCl2(g)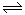 2SOCl2(g)△H2=-bkJ/mol(a>b>0)
2SOCl2(g)△H2=-bkJ/mol(a>b>0)
则△H=________kJ/mol(用a、b的代数式表示)
(2)为了提高该反应中Cl2的平衡转化率,下列措施合理的是________(填字母序号)。
| A.缩小容器体积 | B.使用催化剂 | C.增加SO2浓度 | D.升高温度 |
(3)若在绝热、恒容的密闭体系中,投入一定量SO2和Cl2,发生该反应,下列示意图能说明t1 时刻反应达到平衡状态的是(填字母序号)。(下图中υ正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
(4)若在催化剂作用下,将n molSO2与nmolCl2充入容积可变的密闭容器中,并始终保持温度为T,压强为P。起始时气体总体积为10L,t min时反应达到平衡状态,此时气体总体积为8L。
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示。则υ(SO2)= _________。
②此温度下,该反应的K=_________。
③相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是_________。
(5)该反应的产物SO2Cl2遇水发生剧烈水解生成两种强酸,写出其化学方程式_______________;已知 于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是______。
于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是______。
相关知识点
推荐试卷
 粤公网安备 44130202000953号
粤公网安备 44130202000953号