某研究性实验小组欲验证浓硝酸在与Cu、Ag合金的反应过程中除生成NO2气体外,还会有少量NO生成、并测定Cu、Ag合金中Cu的质量分数。查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。”为此,他们设计了如下图所示的装置。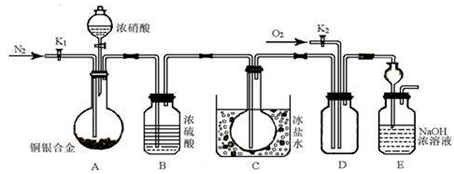
请回答下列问题
(1)写出A中Cu与HNO3反应可能的化学方程式 。
(2)实验开始前先打开A部分的活塞K1,持续通入一段时间的氮气再关闭K1,其目的是 ;装置中B瓶的作用是 。
(3)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是 。
(4)为减小实验误差,在A中反应完成和D中出现现象后,还应继续进行的操作是 。
(5)实验测得如下数据:实验前,Cu、Ag合金的质量:15.0g,浓HNO3:40mL 13.5 mol·L1;实验后A溶液:V=40mL c(H+)=1.0 mol·L1。假设反应中HNO3既无挥发也无分解,则:参加反应的HNO3的物质的量
为 mol。
(6)若已知Cu、Ag合金的质量为m g,且溶解完全。请利用A装置中反应后的溶液进行简单的操作,以确定合金中Cu的质量分数,其实验过程为 。
相关知识点
推荐试卷
 粤公网安备 44130202000953号
粤公网安备 44130202000953号