在某一容积为5 L的密闭容器内,加入 0.3 mol的CO和0.3 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如图:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如图: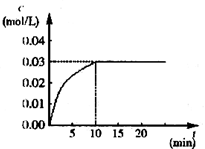
(1)根据图上数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)= mol/(L·min)-1,该温度下的平衡常数K= 。
(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有 (填字母)
A升高温度;B降低温度;C增大压强;D减小压强;E加入催化剂;G移出一氧化碳气体
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.2 mol的CO2和0.2 mol的H2,在相同的条件下,反应达平衡时,c(CO)= mol/L。
(4)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol 的水蒸气,重新达到平衡后,CO的转化率 (填“升高”、“降低”还是“不变”),CO2的质量分数 (填“升高”、“降低”还是“不变”)。
(5)在催化剂存在和800℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09mol/L,c(CO2)=c(H2)=0.13mol/L,则此反应是否处于平衡状态 (填“是”或“否”),若没有处于平衡状态则该反应向 移动。(填“正方向”或“逆方向”)
推荐试卷
 粤公网安备 44130202000953号
粤公网安备 44130202000953号