推荐试卷
Copyright ©2020 版权所有 广东启点学教育科技有限公司 粤ICP备20024846号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
技术支持:广东启点学教育科技有限公司 4.4.4
 (1)写出的基态原子核外电子排布式。
(1)写出的基态原子核外电子排布式。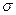 键和键,中与原子间不形成上述健。从原子半径大小的角度分析,为何、原子间能形成,而、原子间不能形成上述键。
键和键,中与原子间不形成上述健。从原子半径大小的角度分析,为何、原子间能形成,而、原子间不能形成上述键。